Nutrihyl®
Description
Le Hyaluronate de sodium (hyaluronane ou sel de sodium de l’acide hyaluronique) est un glucosaminoglycane non sulfaté. C’est un polysaccharide linéaire formé d’unités disaccharidiques d’acide D-glucuronique et de N-acetylglucosamine, reliés par des liaisons β (1 3). Ces disaccharides sont reliés par des liaisons β (1 4) formant un poly (β-D-glucuronate-[1 3]-β-N-acetyl-D-glucosamine-[1 4]) négativement chargé. La formule moléculaire du β-sodium-D-glucuronate-[1 3]-β-N-acetyl-D-glucosamine est [C14H20O11NNa]n, où n = 250 - 5000.
Le hyaluronate de sodium est présent chez tous les vertébrés, principalement dans les tissus conjonctifs tels que le cartilage, os, peau, etc, et les fluides corporels. C’est une substance non toxique, non cytotoxique, non-immunogène et non mutagène.
Nom chimique
Hyaluronate de sodium
Forme disponible
poudre
Dosage
Homme: 7 à 70 mg par jour, selon l’application visée
Cheval: 50 à 250 mg par jour
Allégations
Confort articulaire, Prévention de l’ostéoporose, Beauté de la peau et des cheveux
Formes d’application
gélules, comprimés, gels, sirops
Questions: sales@contipro.com
Solubilité
Hydrosoluble. Le hyaluronate de sodium d’un poids moléculaire supérieur à 1MDa forme une solution visqueuse à une concentration de 1%. La viscosité augmente proportionnellement avec l’élévation du poids moléculaire jusqu’à la formation d’un gel à une concentration de 2%. Du fait de la présence d’acide glucuronique dans la structure, le hyaluronane forme des sels avec différents cations. Les sels simples tels que sodium, potassium, calcium, magnésium, etc., sont totalement hydrosoluble contrairement aux sels constitués de cations polymères ou hydrophobes.
Soluble dans les mélanges alcool-eau si la proportion d’alcool est inférieure à 40%.
Insoluble des les solvants apolaires
Stockage
- Conserver dans son emballage d’origine dans un lieu frais et sec.
- Durée de conservation : 24 mois
Influence du Nutrihyl® (hyaluronate de sodium) sur l’arthrite à adjuvant de Freud expérimentale
Nous avons étudié l’influence du Nutrihyl® sur le développement de l’arthrite à adjuvant induite après injection chez le rat d’une suspension de mycobactéries tuées thermiquement dans un adjuvant de Freud incomplet. Différents poids moléculaires de Nutrihyl® ont été administrés par sonde par voie orale à des dosages variés.
Résultats
Nutrihyl® dont le poids moléculaire est supérieur à 1MDa diminue significativement le gonflement des articulations des pattes de derrière touchées par l’arthrite (14ième jour p < 0.05, 21ième et 28ième jour p < 0.001). Il est efficace à très faible concentration puisque 0.1 mg/kg de masse corporelle suffisent.
Distribution du Nutrihyl® après administration orale
Pour évaluer le mécanisme du Nutrihyl® après administration orale, il est essentiel de commencer par des observations de sa pharmacocinétique. Dans la littérature, nous trouverons de nombreuses références sur les pharmacocinétiques du hyaluronane après administration intraveineuse ou application topique, mais peu de données après administration orale (Réf 1-5). Dans un article sur la pharmacocinétique du hyaluronane, l’auteur décrit chez le rat des tests biologiques avec un hyaluronane (Nutrihyl®) marqué au Technetium 99m (99mTc), où seulement 5% du hyaluronane marqué a été absorbé. Plus de 90% de la radioactivité est retrouvée dans les excréments après 72 heures. La radioactivité a été mesurée dans le sang, les muscles, les glandes salivaires et les os dès 30 minutes et atteignait son niveau maximum au bout de 4 à 6 heures dans tous les tissus non alimentaires examinés après administration orale. Il y avait une élévation temporaire de la radioactivité dans les articulations de l’épaule et des vertèbres 4 heures après administration orale. Ces résultats démontrent qu’après administration orale le hyaluronane est absorbé et distribué dans les organes et les articulations (Réf 6-7).
1) Smedsrod, B., Pertoft, H., Eriksson, S., Fraser, J.R.E. and Laurent, T. Studies in vitro on the uptake and degradation of sodiumhyaluronate in rat liver endothelial cells, Biochem J. (1984), 223, 617-626
2) Nimrod, A., Ezra, E., Ezov, N., Nachum, G., and Parisada, B. Absorption, distribution, metabolism, and excretion of bacteria-derived hyaluronic acid in rats and rabbits, J. Ocul Pharmacol (1992), 8, 161-172
3) Reed, R.K., Townsley, M.I., Laurent, T.C., Taylor A.E. Hyaluronan flux from from cat intestine: changes with lymph flow, Am J. Physiol Heart Circ Physiol (1992), 262,H457-H462
4) Brown, T.J., Alcorn, D., Robert, J. and Fraser, E. Absorption of hyaluronan applied to the surface of intact skin, J. Invest Dermatol (1999) , 113, 740-746
5) Breborowicz, A., Polubinska, A., Pawlaczyk, K., Kuzlan-Pawlaczyk, M., Moberly, J., Martis, L. and Oreopoulos, D., Interperitoneal hyaluronan administration in concious rats: absorption, metabolism, and effects on peritoneal fluid dynamics, Peritoneal Dial Internat (2001), 21, 130-136
6) Schauss, A.G., Balogh, L.G., Polyak A.G., Mathe D.G., Kiraly R.G. and Janoki, G.G. Absorption, distribution and excretion of the 99mtechnetium labeled hyaluronan after single oral doses in rats and beagle dogs, Experimental biology (2004), Washington (2004)
7) Thierry, B., Winnik, F.M., Merhi, Y., Silver, J. And Tabrizian, M. Radionuclides-hyaluronan-conjugate thomboresistant coating to prevent in-stent restenosis, Biomaterials (2004), 25, 3895-3905
Influence du Nutrihyl® sur les différents processus inflammatoires et dégénératifs dans les tendons et les articulations chez le cheval.
L’étude a été menée comme une simple étude ouverte multicentrique dans 7 cliniques vétérinaires. Nutrihyl® a été administré par voie orale pendant 30 jours à 53 chevaux de course souffrant de synovites aigües, subaigües et chroniques, ostéochondroses, arthrites, tendinites et ténosynovites. L’effet du traitement a été évalué par les vétérinaires selon les critères suivants : état clinique général, gonflement, douleur des mouvements passifs, degré de boitement, raideur des membres après repos, évaluation fonctionnelle avant et après 30 jours de traitement, puis après 30 jours supplémentaires à partir de la fin du traitement. Les résultats finaux sont présentés dans la figure 1.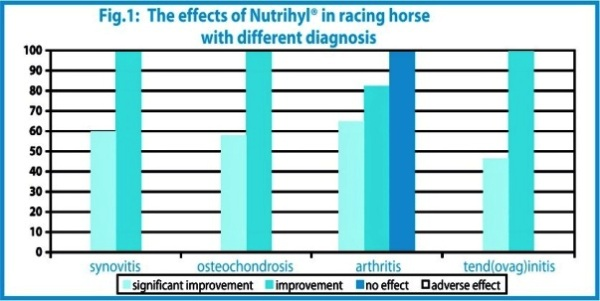
Influence de la combinaison Nutrihyl®/ chondroïtine sulphate sur les articulations du genou après chirurgie
L’étude a été réalisée à la clinique orthopédique de l’université de Prague sur 27 patients se remettant d’une opération du genou. Il a été administré au groupe par voie orale un mélange Nutrihyl®/ chondroïtine sulphate pendant 90 jours. L’efficacité du traitement a été exprimée selon les paramètres suivants : gonflement et douleur des articulations et faculté de mouvement. L’état des patients a été évalué avant et après traitement soit par les patients eux-mêmes (résultats subjectifs) soit par les médecins (résultats cliniques). Les résultats finaux sont présentés dans la figure 2. 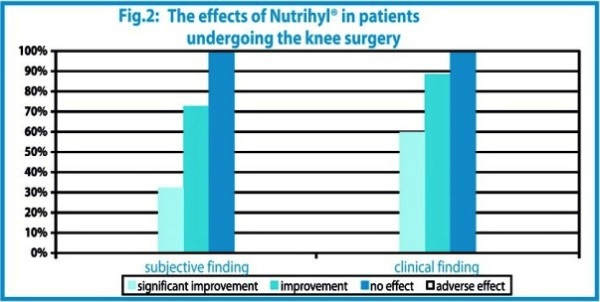
L’effet de la chondroïtine sulphate à une dose manifestement inférieure à la dose thérapeutique est très probablement non significative comme cela a été démontré dans notre étude sur les chevaux de course. Par conséquent nous pouvons conclure que l’efficacité de la préparation utilisée pour cette étude peut être attribuée uniquement au Nutrihyl®.
Influence du Nutrihyl® sur l’état des articulations du genou chez des joueurs de hockey sur glace.
L’étude a été réalisée à l’Institut locomoteur de Prague sur 24 joueurs de hockey sur glace de ligue 1. Le groupe a été traité sur une durée de 90 jours pendant le championnat. L’efficacité du traitement a été exprimée selon les paramètres suivants : mouvement et stabilité des articulations, force des muscles, problèmes intra-articulaires. L’état des sportifs a été évalué par un médecin avant et après le traitement.) Les résultats finaux sont présentés dans la figure 3.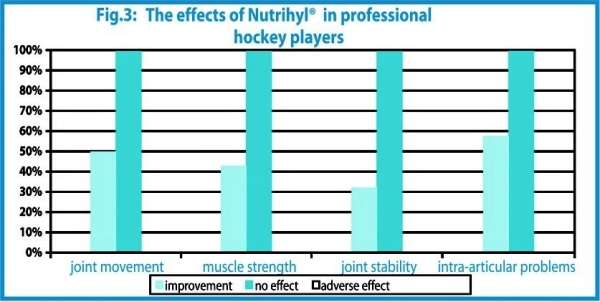
Influence du Nutrihyl® sur l’ostéoporose provoquée expérimentalement.
L’ostéoporoses a été expérimentalement provoquée sur des rates de laboratoire ovariectomisées. Nous avons observé les effets du Nutrihyl® administré per os à différents poids moléculaires et différentes doses sur les paramètres caractérisant la dégradation et la densité des os. L’expérience avec des rates ovariectomisées simule celle avec des femmes ménauposées.
Résultats
- Dans le groupe des rates ovariectomisées mais non traitées par le Nutrihyl®, les taux dans les urines de pyridinoline et deoxypyridinoline (marqueurs de la dégradation des os) augmentait jusqu’à 158% par rapport au groupe de contrôle des rates non ovariectomisées. Dans le groupe des rates ovariectomisées et traitées par un Nutrihyl® de poids moléculaire supérieur à 1.3MDa, les taux de pyridinoline et deoxypyridinoline n’augmentaient que de106%. Nutrihyl® réduit significativement la sécrétion des marqueurs de la dégradation des os dans les urines.
- Dans le groupe des rates ovariectomisées mais non traitées par le Nutrihyl®, les taux dans les urines de pyridinoline et deoxypyridinoline (marqueurs de la dégradation des os) augmentait jusqu’à 158% par rapport au groupe de contrôle des rates non ovariectomisées. Dans le groupe des rates ovariectomisées et traitées par un Nutrihyl® de poids moléculaire supérieur à 1.3MDa, les taux de pyridinoline et deoxypyridinoline n’augmentaient que de106%. Nutrihyl® réduit significativement la sécrétion des marqueurs de la dégradation des os dans les urines.
- Le Nutrihyl® dont le poids moléculaire est supérieur à 1,3MDa a la faculté d’éliminer les symptômes de l’ostéoporose.
L’influence du Nutrihyl® sur la peau et les cheveux
Nos résultats (réf. 8) montrent que le Nutrihyl active la synthèse de l’oxyde nitrique. Le taux de nitrate et nitrite, les métabolites de l’oxyde nitrite, augmente dans le sérum sanguin après absorption du Nutrihyl® par voie orale. Il est connu que l’oxyde nitrique a un effet positif sur la cicatrisation, la pousse des cheveux et d’autres processus dans la peau (réf. 9-11). Ces résultats suggèrent que par voie orale Nutrihyl® pourrait avoir un effet positif sur l’état général de la peau et des cheveux et être un complément nutritionnel idéal aux soins cosmétiques topiques réparateurs et anti-âge.
8) Stancikova, M., Svik, K., Istok, R. and Velebny, V. The effects of hyaluronan on bone resorption and bone mineral density in rat model of estrogen deficiency-induced osteopenia, Tissue reaction, in press
9) Schwentker, A., Vodovotz, Y., Weller, R. And Billiar, T.R. Nitric oxide and wound repair: role of cytokines Nitric oxide (2002), 7, 1-10
10) Frank, S., Kaempfer, H., Wetzler, C., Pfeilchifter, J., Nitric oxide drives skin repair: Novel function of an established mediator, Kidney Internat (2002), 61, 882-888
11) Mochizuki, S., Vink, H., Hiramatsu, O., Kajita, T., Shigeto, F., Spaan, J.A.E. and Kajiya, F. Role of hyaluronic acid glycosaminoglycans in shear-induced endothelium-derived nitric oxide release, Am J. Physiol Heart Circ Physiol (2003), 285, H722-H726
Pharmacocinétique du Nutrihyl® après absorption par voie orale.
Etude disponible sur demande

